Page 47 - 11-kimya-beceri-temelli-soru
P. 47
KONULAR
• ELEMENTLERİ TANIYALIM
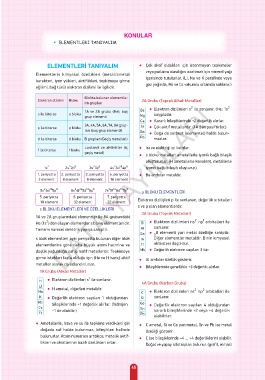
ELEMENTLERİ TANIYALIM ● Çok aktif oldukları için istenmeyen tepkimeler
veya patlama olasılığını azaltmak için mineral yağı
Elementlerin kimyasal özellikleri (metal/ametal
karakteri, iyon yükleri, aktiflikleri, tepkimeye girme içerisinde tutulurlar. (Li, Na ve K parafinde veya
gaz yağında, Rb ve Cs vakumlu ortamda saklanır.)
eğilimi, bağ türü) elektron dizilimi ile ilgilidir.
Blokta bulunan elementle-
Elektron dizilimi Bloku 2A Grubu (Toprak Alkali Metaller)
rin grupları
2
2
1A ve 2A grubu (He), baş Be ● Elektron dizilimleri s ile sonlanır. (He: 1s
s ile biterse s bloku soygazdır.
grup elementi Mg
Ca ● Kararlı bileşiklerinde +2 değerlik alırlar.
3A, 4A, 5A, 6A, 7A, 8A grup-
p ile biterse p bloku Sr ● Çok aktif metallerdir. (1A dan pasiftirler.)
ları (baş grup elementi) Ba ● Doğa da serbest (elementel) halde bulun-
d ile biterse d bloku B grupları (Geçiş metalleri) Ra mazlar.
Lantanit ve aktinitler (iç ● Isı ve elektriği iyi iletirler.
f ile biterse f bloku
geçiş metal)
● s bloku metalleri ametallerle iyonik bağlı bileşik
oluştururlar. (H ametallerle kovalent, metallerle
2
2
10
2
1s 2 2s 2p 6 3s 3p 6 4s 3d 4p 6 iyonik bağlı bileşik oluşturur.)
1. periyotta 2. periyotta 3. periyotta 4. periyotta ● Be amfoter metaldir.
2 element 8 element 8 element 18 element
10
6
2
14
10
6
2
14
10
2
5s 4d 5p 6 DATA YAYINLARI
7s 5f 6d 7p
6s 4f 5d 6p
p BLOKU ELEMENTLERİ
5. periyotta 6. periyotta 7. periyotta Elektron dizilişleri p ile sonlanan, değerlik orbitalleri
18 element 32 element 32 element
s ve p olan elementlerdir.
s BLOKU ELEMENTLERİ VE ÖZELLİKLERİ
3A Grubu (Toprak Metalleri)
1A ve 2A gruplarındaki elementler ile 8A grubundaki
2
1
2
He (1s ) den oluşan elementler s bloku elementleridir. B ● Elektron dizilimleri ns np orbitalleri ile
Tamamı küresel simetrik yapıya sahiptir. AI sonlanır.
Ga ● B elementi yarı metal özelliğe sahiptir.
5
s blok elementleri aynı periyotta bulunan diğer blok In Diğer elementler metaldir. B nin kimyasal
elementlerine göre daha büyük atom hacmine ve TI aktivitesi düşüktür.
düşük yoğunluğa sahip hafif metallerdir. Tepkimeye Nh ● Değerlik elektron sayıları 3 tür.
girme istekleri fazla olduğu için (He ve H hariç) aktif ● AI amfoter özellik gösterir.
metaller olarak da adlandırılırlar.
● Bileşiklerinde genellikle +3 değerlik alırlar.
1A Grubu (Alkali Metaller)
1
H ● Elektron dizilimleri s ile sonlanır. 4A Grubu (Karbon Grubu)
Li ● H ametal, diğerleri metaldir.
2
2
Na C ● Elektron dizilimleri ns np orbitalleri ile
K ● Değerlik elektron sayıları 1 olduğundan Si sonlanır.
Rb bileşiklerinde +1 değerlik alırlar. (hidrojen Ge ● Değerlik elektron sayıları 4 olduğundan
Cs –1 de alabilir.) Sn kararlı bileşiklerinde +2 veya +4 değerlik
Fr Pb alabilirler.
● Ametallerle, hava ve su ile tepkime verdikleri için ● C ametal, Si ve Ge yarı metal, Sn ve Pb ise metal
doğada saf halde bulunmaz, bileşikleri halinde özelliği gösterir.
bulunurlar. Atom numarası arttıkça; metalik aktif- ● C ise bileşiklerinde –4 ... +4 değerliklerini alabilir.
likleri ve oksitlerinin bazik özellikleri artar. Doğal ve yapay allotropları bulunur. (grafit, elmas)
45