Page 106 - 7'DEN LGS'YE FEN BİLİMLERİ HAZIRLIK İLK ADIM - EDİTÖR YAYINLARI
P. 106
8. SINIF KONULARINA GİRİŞ ASITLER VE BAZLAR
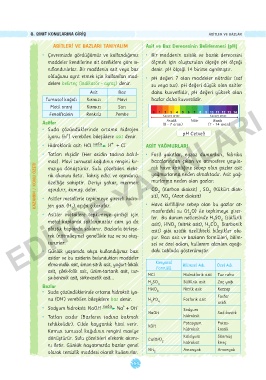
ASITLERI VE BAZLARI TANIYALIM Asit ve Baz Derecesinin Belirlenmesi (pH)
• Çevremizde gördüğümüz ve kullandığımız • Bir maddenin asitlik ve bazlık derecesini
maddeler kendilerine ait özelliklere göre sı- ölçmek için oluşturulan ölçeğe pH ölçeği
nıflandırılırlar. Bir maddenin asit veya baz denir. pH ölçeği 14 birime ayrılmıştır.
olduğunu ayrıt etmek için kullanılan mad- • pH değeri 7 olan maddeler nötrdür (saf
delere belirteç (indikatör - ayraç) denir. su veya tuz). pH değeri düşük olan asitler
Asit Baz daha kuvvetlidir, pH değeri yüksek olan
Turnusol kağıdı Kırmızı Mavi bazlar daha kuvvetlidir.
EDİTÖR YAYINLARI
Metil oranj Kırmızı Sarı
4
2
3
Fenolftalein Renksiz Pembe 0 1 Kuvvet artar. 5 6 7 8 9 10 11 12 13 14
Kuvvet artar.
Asidik
Bazik
Asitler (0 - 7 arası) Nötr (7 - 14 arası)
• Suda çözündüklerinde ortama hidrojen
+
iyonu (H ) verebilen bileşiklere asit denir. pH Cetveli
+
• Hidroklorik asit: HCl suda H + Cl - ASIT YAĞMURLARI
• Tatları ekşidir (Her asidin tadına bakıl- • Fosil yakıtlar, egzoz dumanları, fabrika
maz). Mavi turnusol kağıdının rengini kır- bacalarından çıkan ve atmosfere yayıla-
KAZANIM / KONU ÖZETI • Asitler metallerle tepkimeye girerek hidro- • CO (Karbon dioksit) , SO (Kükürt diok-
rak hava kirliliğine sebep olan gazlar asit
mızıya dönüştürür. Sulu çözeltileri elekt-
yağmurlarına neden olmaktadır. Asit yağ-
rik akımını iletir. Tahriş edici ve aşındırıcı
murlarına neden olan gazlar:
özelliğe sahiptir. Deriyi yakar, mermeri
aşındırır, kumaşı deler.
2
2
sit), NO (Azot dioksit)
2
jen gazı (H ) açığa çıkarırlar.
2
mosferdeki su (H O) ile tepkimeye girer-
2
• Asitler metallere tepkimeye girdiği için • Hava kirliliğine sebep olan bu gazlar at-
ler. Bu durum neticesinde H SO (sülfürik
4
2
metal kaplarda saklanmazlar cam ya da asit), HNO (nitrik asit), H CO (karbonik
3
2
3
plastik kaplarda saklanır. Bazlarla birleşe- asit) gibi asidik özellikteki bileşikler olu-
rek (nötralleşme) genellikle tuz ve su oluş- şur. Bazı asit ve bazların formülleri, bilim-
tururlar. sel ve özel adları, kullanım alanları aşağı-
• Günlük yaşamda sıkça kullandığımız bazı daki tabloda gösterilmiştir.
asitler ve bu asitlerin bulundukları maddeler
elma-malik asit, limon-sitrik asit, yoğurt-laktik Kimyasal Bilimsel Adı Özel Adı
Formülü
asit, çilek-folik asit, üzüm-tartarik asit, tur- HCl Hidroklorik asit Tuz ruhu
şu-benzoik asit, sirke-asetik asit...
H SO Sülfürik asit Zaç yağı
2
Bazlar HNO 4 Nitrik asit Kezzap
• Suda çözündüklerinde ortama hidroksit iyo- 3
-
nu (OH ) verebilen bileşiklere baz denir. H PO Fosforik asit Fosfor
3 4 asidi
+
• Sodyum hidroksit: NaOH suda Na + OH - Sodyum
NaOH Sud-kostik
• Tatları acıdır (Bazların tadına bakmak hidroksit
tehlikelidir). Cilde kayganlık hissi verir. KOH Potasyum Potas-
Kırmızı turnusol kağıdının rengini maviye hidroksit kostik
dönüştürür. Sulu çözeltileri elektrik akımı- Ca(OH) Kalsiyum Sönmüş
nı iletir. Günlük hayatımızda bazlar genel 2 hidroksit kireç
olarak temizlik maddesi olarak kullanırlar. NH 3 Amonyak Amonyak
1066
10