Page 51 - 9. SINIF KİMYA FAVORİ DEFTERİM
P. 51
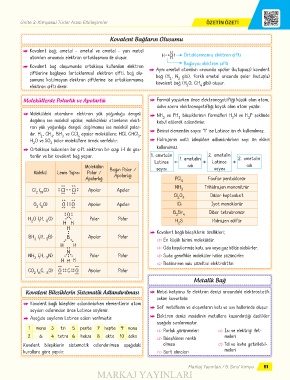
Ünite 3: Kimyasal Türler Arası Etkileşimler ÖZETİN ÖZETİ
Kovalent Bağların Oluşumu
Q Kovalent bağ; ametal - ametal ve ametal - yarı metal
atomları arasında elektron ortaklaşması ile oluşur. H Cl Ortaklanmamış elektron çifti
Bağlayıcı elektron çifti
Q Kovalent bağ oluşumunda ortaklaşa kullanılan elektron
çiftlerine bağlayıcı (ortaklanmış) elektron çifti, bağ olu- Q Aynı ametal atomları arasında apolar (kutupsuz) kovalent
bağ (H , N gibi), farklı ametal arasında polar (kutuplu)
2
2
şumuna katılmayan elektron çiftlerine ise ortaklanmamış kovalent bağ (H O, CH gibi) oluşur.
elektron çifti denir. 2 4
Moleküllerde Polarlık ve Apolarlık Q Formül yazılırken önce elektronegatifliği küçük olan atom,
daha sonra elektronegatifliği büyük olan atom yazılır.
Q Moleküldeki atomların elektron yük yoğunluğu dengeli Q NH ve PH bileşiklerinin formülleri H N ve H P şeklinde
3
3
dağılmış ise molekül apolar, moleküldeki atomların elekt- kabul edilerek adlandırılır. 3 3
ron yük yoğunluğu dengeli dağılmamış ise molekül polar-
dır. H , CH , BH ve CCl apolar moleküllere; HCl, CHCl , Q Birinci elementin sayısı “1” ise Latince ön ek kullanılmaz.
2 4 3 4 3
H O ve SO polar moleküllere örnek verilebilir. Q Hidrojenin asitli bileşikleri adlandırılırken sayı ön ekleri
2 2
Q Ortaklaşa kullanılan bir çift elektron bir çizgi (-) ile gös- kullanılmaz.
terilir ve bir kovalent bağ yapar. 1. ametalin 1. ametalin 2. ametalin 2. ametalin
Latince + + Latince +
Molekülün sayısı adı sayısı adı
Molekül Lewis Yapısı Polar / Bağın Polar /
Apolarlığı Apolarlığı PCl Fosfor pentaklorür
5
NH Trihidrojen mononitrür
Cl ( Cl) Cl Cl Apolar Apolar 3
2 17
Cl O Diklor heptaoksit
2 7
O ( O) O O Apolar Apolar lCl İyot monoklorür
2 8
O B Br 4 Dibor tetrabromür
2
H O ( H, O) Polar Polar
2 1 8 H S Hidrojen sülfür
H H 2
H
Q Kovalent bağlı bileşiklerin özellikleri;
BH ( H, B) B Apolar Polar
3 1 5 5 En küçük birimi moleküldür.
H H 5 Oda koşullarında katı, sıvı veya gaz hâlde olabilirler.
N
NH ( H, N) Polar Polar 5 Suda genellikle moleküler hâlde çözünürler.
3 1 7
H H H
5 Bazılarının sulu çözeltisi elektrolittir.
CO ( C, O) O C O Apolar Polar
2 6 8
Metalik Bağ
Kovalent Bileşiklerin Sistematik Adlandırılması Q Metal katyonu ile elektron denizi arasındaki elektrostatik
çekim kuvvetidir.
Q Kovalent bağlı bileşikler adlandırılırken elementlerin atom
sayıları adlarından önce Latince söylenir. Q Saf metallerin ve alaşımların katı ve sıvı hallerinde oluşur.
Q Aşağıda sayıların Latince adları verilmiştir. Q Elektron denizi modelinin metallere kazandırdığı özellikler
aşağıda sıralanmıştır.
1 mono 3 tri 5 penta 7 hepta 9 nona
5 Parlak görünmeleri 5 Isı ve elektriği ilet-
2 di 4 tetra 6 hekza 8 okta 10 deka meleri
5 Bileşiklerin renkli
Kovalent bileşiklerin sistematik adlandırılması aşağıdaki olması 5 Tel ve levha getirilebil-
kurallara göre yapılır. 5 Sert olmaları meleri
Markaj Yayınları / 9. Sınıf Kimya 51
MARKAJ YAYINLARI