Page 275 - 9. SINIF VIP TÜM DERSLER KONU ANLATIMLI - EDİTÖR YAYINLARI
P. 275
2. Tema: Çeşitlilik
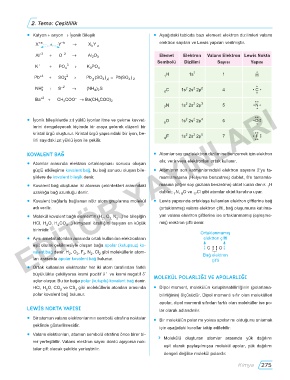
• Katyon + anyon → Iyonik Bileşik • Aşağıdaki tabloda bazı element elektron dizilimleri valans
X + a + Y − b → XY a elektron sayıları ve Lewis yapıları verilmiştir�
b
Al +3 + O −2 → AlO 3 Elemet Elektron Valans Elektron Lewis Nokta
2
Sembolü Dizilimi Sayısı Yapısı
K + + PO −3 → K PO 4
3
4
H 1s 1 1 H
Pb +4 + SO −2 → Pb (SO )) = Pb (SO ) 1
4
42
4 4
2
NH + 4 + S − 2 → (NH 42 C 1s 2s 2p 2 4 C
) S
2
2
6
(
Ba + 2 + CH COO − → BaCHCOO ) 2
EDİTÖR YAYINLARI
3
3
2
2
N 1s 2s 2p 3 5 N
7
• Iyonik bileşiklerde zıt yüklü iyonlar itme ve çekme kuvvet- 8 O 1s 2s 2p 4 6 O
2
2
lerini dengeleyecek biçimde bir araya gelerek düzenli bir
kristal örgü oluşturur� Kristal örgü yapısındaki bir iyon, be- F 1s 2s 2p 5 7 F
2
2
lirli sayıdaki zıt yüklü iyon ile çekilir� 9
KOVALENT BAĞ • Atomlar soy gaz elektron dizilimine benzemek için elektron
• Atomlar arasında elektron ortaklaşması sonucu oluşan alır, verir veya elektronları ortak kullanır�
güçlü etkileşime kovalent bağ, bu bağ sonucu oluşan bile- • Atomların son katmanlarındaki elektron sayısını 2’ye ta-
şiklere de kovalent bileşik denir� mamlamasına (Helyuma benzetme) dublet, 8’e tamamla-
• Kovalent bağ oluşturan iki atomun çekirdekleri arasındaki masına (diğer soy gazlara benzetme) oktet kuralı denir� H
1
uzaklığa bağ uzunluğu denir� dublet; N, O ve Cl gibi atomlar oktet kuralına uyar�
7
8
17
• Kovalent bağlarla bağlanan nötr atom gruplarına molekül • Lewis yapısında ortaklaşa kullanılan elektron çiftlerine bağ
adı verilir� (ortaklanmış) valans elektron çifti, bağ oluşumuna katılma-
• Molekül kovalent bağlı elementin (H , O N ���) ve bileşiğin yan valans elektron çiftlerine ise ortaklanmamış (eşleşme-
2
2, 2
HCl, H O, H CO ���) kimyasal özelliğini taşıyan en küçük miş) elektron çifti denir�
2
2
3
birimidir� Ortaklanmamış
• Aynı ametal atomları arasında ortak kullanılan elektronların elektron çifti
eşit olarak çekilmesiyle oluşan bağa apolar (kutupsuz) ko- C O
valent bağ denir� H , O , F , N , Cl gibi moleküllerin atom- Bağ elektron
2
2
2
2
2
ları arasında apolar kovalent bağ bulunur� çifti
• Ortak kullanılan elektronlar her iki atom tarafından farklı
+
büyüklükte çekiliyorsa kısmi pozitif δ ve kısmi negatif δ - MOLEKÜL POLARLIĞI VE APOLARLIĞI
uçlar oluşur� Bu tür bağa polar (kutuplu) kovalent bağ denir�
HCl, H O, CO ve CS gibi moleküllerin atomları arasında • Dipol moment, molekülün kutuplanabilirliğinin (polarlana-
2
2
2
polar kovalent bağ bulunur� bilirliğinin) ölçüsüdür� Dipol momenti sıfır olan molekülleri
apolar, dipol momenti sıfırdan farklı olan moleküller ise po-
LEWIS NOKTA YAPISI lar olarak adlandırılır�
• Bir atomun valans elektronlarının sembolü etrafına noktalar • Bir molekülün polar mı yoksa apolar mı olduğunu anlamak
şeklinde gösterilmesidir� için aşağıdaki kurallar takip edilebilir:
• Valans elektronları, atomun sembolü etrafına önce birer bi- › Molekülü oluşturan atomlar arasında yük dağılımı
rer yerleştirilir� Valans elektron sayısı dördü aşıyorsa nok-
talar çift olacak şekilde yerleştirilir� eşit olarak paylaşılmışsa molekül apolar, yük dağılımı
dengeli değilse molekül polardır�
Kimya 275