Page 48 - 9_kimya_ogretmenin
P. 48
46 ATOM VE PERİYODİK SİSTEM
ˇ Bir periyotta element atomlarının birinci iyonlaşma enerjilerinin sıralanışı;
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A şeklindedir.
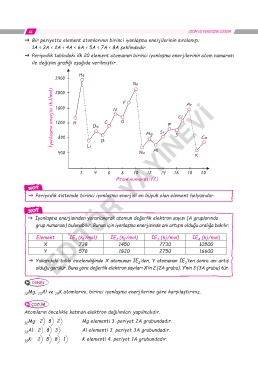
ˇ Periyodik tablodaki ilk 20 element atomunun birinci iyonlaşma enerjilerinin atom numarası
ile değişim grafiği aşağıda verilmiştir.
He
2400
Ne
İyonlaşma enerjisi (kJ/mol) 1600 H Be C N O F Mg Si P S Cl Ar
2000
1200
800
Al
Na
400 Li B YAYINEVİ Ca
K
2 4 6 8 10 12 14 16 18 20
Atom numarası (Z)
EDİTÖR
NOT
ˇ Periyodik sistemde birinci iyonlaşma enerjisi en büyük olan element helyumdur.
NOT
ˇ İyonlaşma enerjisinden yararlanarak atomun değerlik elektron sayısı (A gruplarında
grup numarası) bulunabilir. Bunun için iyonlaşma enerjisinde ani artışın olduğu aralığa bakılır.
Element İE (kj/mol) İE (kj/mol) İE (kj/mol) İE (kj/mol)
3
4
1
2
X 738 1450 7730 10500
Y 578 1820 2750 16600
ˇ Yukarıdaki tablo incelendiğinde X atomunun İE ’den, Y atomunun İE ’ten sonra ani artış
2
3
olduğu görülür. Buna göre değerlik elektron sayıları X’in 2 (2A grubu), Y’nin 3 (3A grubu) tür.
Mg, Al ve K atomlarını, birinci iyonlaşma enerjilerine göre karşılaştırınız.
12 13 19
ÇÖZÜM
Atomların öncelikle katman elektron dağılımları yapılmalıdır.
Mg: 2 8 2 Mg elementi 3. periyot 2A grubundadır.
12
Al: 2 8 3 Al elementi 3. periyot 3A grubundadır.
13
K: 2 8 8 1 K elementi 4. periyot 1A grubundadır.
19