Page 185 - 11-kimya-beceri-temelli-soru
P. 185
BECERİ TEMELLİ YENİ NESİL ETKİNLİKLER
A Aşağıda verilen ifadelerin doğru (D) veya yanlış (Y) olduk- C Aşağıdaki tepkimelerle verilen hız ölçüm yöntemleri ile
larını belirtiniz. uygun şekilde eşleştiriniz.
1. Kimyasal tepkimede bütün çarpışmalar ürünle
-
+
sonuçlanır. SO (g) + H O(g) H (suda) + HSO (suda)
1 3 2 4
2. Aynı sıcaklıkta aktifleşme enerjisi büyük olan
tepkime daha yavaştır. AgNO (suda) + NaCl(suda) AgCl(k) + NaNO (suda)
2 3 3
3. Çok basamaklı tepkimelerde hızı belirleyen
yavaş basamaktır. 3 2NH (g) N (g) + 3H (g)
2
2
3
4. Pozitif katalizör tepkimenin aktifleşme enerji-
sini azaltarak tepkimenin hızını azaltırlar. 4 CH (g) + 2O (g) CO (g) + 2H O(g)
4
2
2
2
5. İleri aktifleşme enerjisinin değeri geri aktif- H (g) + Br (g) 2HBr(g)
2
2
DATA YAYINLARI
leşme enerjisinin değerinden büyük olan tep- 5 renksiz kırmızı renksiz
kimeler endotermiktir.
6. Kimyasal tepkimelerde yüksek enerjili ve kısa a. Basınç artışı (sabit hacim ve sıcaklıkta)
ömürlü ara ürün aktifleşmiş kompleks olarak b. Renk değişimi
adlandırılır.
c. Sıcaklık artışı (yalıtkan kapta)
7. Kimyasal tepkimelerde hız bağıntılarına saf
katı ve sıvılar yazılmaz. d. pH azalışı
8. Tepkimede sıcaklık artırılırsa taneciklerin e. İletkenlik azalışı (sabit sıcaklıkta)
ortalama kinetik enerjileri artar.
9. Hız sabiti k nın değeri her zaman 1 den büyük-
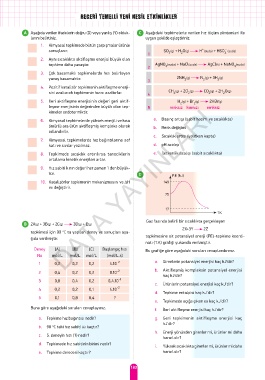
tür. D P.E (kJ)
10. Katalizörler tepkimenin mekanizmasını ve DH 149
ını değiştirir.
75
17
TK
Gaz fazında belirli bir sıcaklıkta gerçekleşen
B 2A(g) + 3B(g) + 2C(g) 3D(g) + E(g)
2X+3Y 2Z
tepkimesi için 90 °C ta yapılan deney ve sonuçları aşa-
ğıda verilmiştir. tepkimesine ait potansiyel enerji (PE)-tepkime koordi-
natı (T.K) grafiği yukarıda verilmiştir.
Deney [A] [B] [C] Başlangıç hızı Bu grafiğe göre aşağıdaki soruları cevaplandırınız.
No mol/L mol/L mol/L (mol/L.s)
1 0,2 0,2 0,2 4.10 -2 a. Girenlerin potansiyel enerjisi kaç kJ'dir?
2 0,4 0,2 0,2 8.10 -2 b. Aktifleşmiş kompleksin potansiyel enerjisi
kaç kJ'dir?
3 0,8 0,4 0,2 6,4.10 -1
c. Ürünlerin potansiyel enerjisi kaç kJ'dir?
4 0,2 0,2 0,1 4.10 -2
d. Tepkime entalpisi kaç kJ'dir?
5 0,1 0,8 0,4 ?
e. Tepkimede açığa çıkan ısı kaç kJ'dir?
Buna göre aşağıdaki soruları cevaplayınız. f. İleri aktifleşme enerjisi kaç kJ'dir?
a. Tepkime hız bağıntısı nedir? g. Geri tepkimenin aktifleşme enerjisi kaç
kJ'dir?
b. 90 °C taki hız sabiti (k) kaçtır?
h. Enerji yönünden girenler mi, ürünler mi daha
c. 5. deneyin hızı (?) nedir? kararlıdır?
d. Tepkimede hız sabitinin birimi nedir? i. Yüksek sıcaklıkta girenler mi, ürünler mi daha
e. Tepkime derecesi kaçtır? kararlıdır?
183