Page 70 - 11-kimya-beceri-temelli-soru
P. 70
c) Sıcaklık (T): Sıcaklık taneciklerin ortalama kine- P₀
tik enerjilerinin bir ölçüsüdür, termometre ile ölçü-
lür. Mutlak sıcaklığın birimi Kelvin (K) dir. ideal piston
P₀ T² > T¹
● Gazlarda sıcaklıklar kelvin sıcaklık birimi olarak V¹ ideal V² Gaz V¹ = V²
kullanılmalıdır. Gaz piston T¹ T²
T T
1 2
K = °C + 273
V V
● 0 Kelvin sıcaklığına mutlak sıfır noktası denir. V² V²
DATA YAYINLARI
V¹
K ˚C V¹
T (K) t (˚C)
273 0 T¹ T² -273 t¹ t²
0 273 K
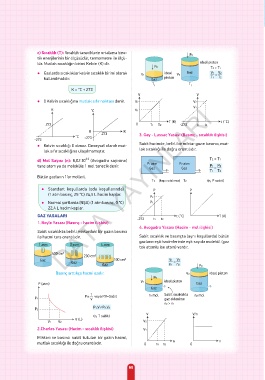
˚C -273 3. Gay - Lussac Yasası (Basınç - sıcaklık ilişkisi)
-273
● Kelvin sıcaklığı 0 olmaz. Deneysel olarak mut- Sabit hacimde, belirli bir miktar gazın basıncı, mut-
lak sıfır sıcaklığına ulaşılmamıştır. lak sıcaklığı ile doğru orantılıdır.
23
d) Mol Sayısı (n): 6,02.10 (Avogadro sayısına) T² > T¹
tane atom ya da moleküle 1 mol tanecik denir. P¹ atm P² atm P¹ P²
Gaz Gaz =
T¹ T²
Bütün gazların 1’er molleri,
T¹ (kap ısıtılırsa) T² (n, P sabit)
● Standart koşullarda (oda koşullarında) P P
(1 atm basınç, 25 °C) 24,5 L hacim kaplar.
P²
● Normal şartlarda (NŞA) (1 atm basınç, 0 °C) P¹
22,4 L hacim kaplar.
GAZ YASALARI t (˚C) T (K)
-273 t¹ t²
1. Boyle Yasası (Basınç - hacim ilişkisi)
4. Avogadro Yasası (Hacim - mol ilişkisi)
Sabit sıcaklıkta belirli miktardaki bir gazın basıncı
ile hacmi ters orantılıdır. Sabit sıcaklık ve basınçta (aynı koşullarda) bütün
gazların eşit hacimlerinde eşit sayıda molekül (gaz
1 atm 2 atm 4 atm
tek atomlu ise atom) vardır.
400 cm
200 cm
Gaz 100 cm V¹ V²
Gaz =
Gaz n¹ n² P₀
Basınç arttıkça hacmi azalır. V² ideal piston
P₀
V¹ ideal piston
P (atm) Gaz
Gaz
P¹ Pα 1 V veya P.V=Sabit n¹ mol Sabit sıcaklıkta n² mol
gaz eklenirse
n² > n¹
P² P¹.V¹=P².V²
V V/n
(n, T sabit)
V (L)
V¹ V² V²
2.Charles Yasası (Hacim - sıcaklık ilişkisi) V¹
Miktarı ve basıncı sabit tutulan bir gazın hacmi,
mutlak sıcaklığı ile doğru orantılıdır. 0 n¹ n² n 0 n
68