Page 89 - 11-kimya-beceri-temelli-soru
P. 89
KONULAR
• GAZLARDA KİNETİK TEORİ
• GAZ KARIŞIMLARI
• GERÇEK GAZLAR
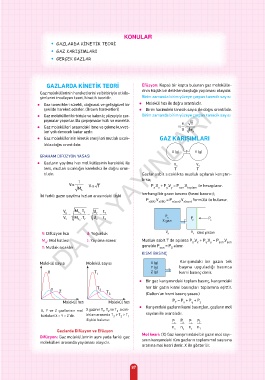
GAZLARDA KİNETİK TEORİ Efüzyon: Kapalı bir kapta bulunan gaz molekülle-
rinin küçük bir delikten boşluğa yayılması olayıdır.
Gaz moleküllerinin hareketlerini ve birbiriyle etkile-
şimlerini inceleyen teori, kinetik teoridir. Birim zamanda birim yüzeye çarpan tanecik sayısı
● Gaz tanecikleri sürekli, doğrusal ve gelişigüzel bir ● Molekül hızı ile doğru orantılıdır.
DATA YAYINLARI
şekilde hareket ederler. (Brown hareketleri) ● Birim hacimdeki tanecik sayısı ile doğru orantılıdır.
● Gaz molekülleri birbiriyle ve kabın iç yüzeyiyle çar- Birim zamanda birim yüzeye çarpan tanecik sayısı
pışmalar yaparlar. Bu çarpışmalar hızlı ve esnektir. n T
● Gaz molekülleri arasındaki itme ve çekme kuvvet- α V .
leri yok denecek kadar azdır. M A
● Gaz moleküllerinin kinetik enerjileri mutlak sıcak- GAZ KARIŞIMLARI
lıkla doğru orantılıdır.
X (g) Y (g)
GRAHAM DİFÜZYON YASASI
● Gazların yayılma hızı mol kütlesinin karekökü ile V V
ters, mutlak sıcaklığın karekökü ile doğru oran- T X T Y
tılıdır. Gazlar sabit sıcaklıkta musluk açılarak karıştırı-
1 lırsa;
Vα Vα T P .V + P .V = P .V ile hesaplanır.
M x x y y son toplam
A
İki farklı gazın yayılma hızları arasındaki ilişki herhangi bir gazın basıncı (kısmi basıncı);
P .V = P .V formülü ile bulunur.
x(ilk) x(ilk) x(son) x(son)
V X = MT = d Y = t Y
Y . X
A
P
V Y M .T Y d X t X X gazı P y P o
X
A
X
V: Difüzyon hızı d: Yoğunluk V X V Y ideal piston
M : Mol kütlesi t: Yayılma süresi Musluk sabit T de açılırsa P .V + P .V = P .V
A x x y y son son
T: Mutlak sıcaklık genelde P son = P alınır.
0
KISMİ BASINÇ
Molekül sayısı Molekül sayısı X (g) Karışımdaki bir gazın tek
Y (g) başına uyguladığı basınca
X T 1 Z (g) kısmi basınç denir.
● Bir gaz karışımındaki toplam basınç, karışımdaki
Y Z T 2 T 3 her bir gazın kısmi basınçları toplamına eşittir.
(Dalton'un kısmi basınç yasası)
Molekül hızı Molekül hızı P = P + P + P z
T
x
y
● Karışımdaki gazların kısmi basınçları, gazların mol
X, Y ve Z gazlarının mol X gazının T , T ve T sıcak-
3
1
2
kütleleri X > Y > Z'dir. lıkları arasında T > T > T 1 sayıları ile orantılıdır.
3
2
ilişkisi bulunur. P x = P y = P z = P T
n x n y n z n T
Gazlarda Difüzyon ve Efüzyon
Difüzyon: Gaz moleküllerinin aynı yada farklı gaz Mol kesri: (X) Gaz karışımındaki bir gazın mol sayı-
molekülleri arasında yayılması olayıdır. sının karışımdaki tüm gazların toplam mol sayısına
oranına mol kesri denir. X ile gösterilir.
87