Page 92 - 11_kimya_ogretmenin
P. 92
90 KİMYASAL TEPKİMELERDE ENERJİ
Standart Oluşum Entalpisi
ˇ Belirli koşullarda bir bileşiğin elementlerinden oluşması sırasındaki ısı değişimine oluşum
entalpisi (oluşum ısısı) denir ve ∆H ile gösterilir.
f
ˇ Standart koşullarda (25 °C ve 1 atm) bir bileşiğin elementlerinden oluşması sırasındaki ısı
değişimine standart oluşum entalpisi (standart oluşum ısısı) denir ve ∆H° ile gösterilir.
f
ˇ Standart koşullarda elementlerin en kararlı hallerinin oluşma entalpisi "sıfır" kabul edilir.
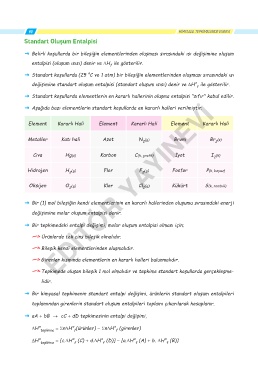
ˇ Aşağıda bazı elementlerin standart koşullarda en kararlı halleri verilmiştir.
Element Kararlı Hali Element Kararlı Hali Element Kararlı Hali
Metaller Katı hali Azot N (g) Brom Br (s)
2
2
İyot
Cıva Hg(s) Karbon YAYINEVİ I (k)
C(k, grafit)
2
Hidrojen H (g) Flor F (g) Fosfor P(k, beyaz)
2
2
EDİTÖR
Oksijen O (g) Klor Cl (g) Kükürt S(k, rombik)
2
2
ˇ Bir (1) mol bileşiğin kendi elementlerinin en kararlı hallerinden oluşumu sırasındaki enerji
değişimine molar oluşum entalpisi denir.
ˇ Bir tepkimedeki entalpi değişimi, molar oluşum entalpisi olması için;
Ürünlerde tek cins bileşik olmalıdır.
F
F
Bileşik kendi elementlerinden oluşmalıdır.
F
Girenler kısmında elementlerin en kararlı halleri bulunmalıdır.
Tepkimede oluşan bileşik 1 mol olmalıdır ve tepkime standart koşullarda gerçekleşme-
F
lidir.
ˇ Bir kimyasal tepkimenin standart entalpi değişimi, ürünlerin standart oluşum entalpileri
toplamından girenlerin standart oluşum entalpileri toplamı çıkarılarak hesaplanır.
ˇ aA + bB → cC + dD tepkimesinin entalpi değişimi,
∆H° tepkime = Σn∆H° (ürünler) - Σn∆H° (girenler)
f
f
∆H° tepkime = [c.∆H° (C) + d.∆H° (D)] - [a.∆H° (A) + b. ∆H° (B)]
f
f
f
f