Page 7 - 10-sinif-kimya-odn
P. 7
KİMYANIN TEMEL KANUNLARI VE 5
KİMYASAL HESAPLAMALAR 1. ÜNİTE
1. KİMYANIN TEMEL KANUNLARI
KIMYANIN TEMEL KANUNLARI
KÜTLE KORUNUMU KANUNU
F Kütlenin Korunumu Kanunu'na göre "Bir kimyasal tepkimede tepkimeye giren madde-
lerin kütleleri toplamı tepkimede oluşan maddelerin kütleleri toplamına eşittir."
F Kütlenin Korunumu Kanunu, Antoine Laurent Lavoisier tarafından bulunmuştur.
EDİTÖR YAYINEVİ
F Lavoisier, içinde kalay ve hava bulunan cam balonun ağzını kapatarak kütlesini ölç-
müştür. Balonu ısıttığında kalayın beyaz bir toza (kalay (II) oksit bileşiğine) dönüştü-
ğünü gözlemlemiş, cam balonu tekrar tarttığında kütlesinin başlangıçtaki kütleye eşit
olduğunu görmüştür.
F Lavoisier'in yaptığı deneylere göre;
❍ Bir kimyasal tepkimede kütle yoktan var edilemez, var olan da yok edilemez.
❍ Tepkimelerde toplam kütle, atom türü ve sayısı değişmez, yani korunur.
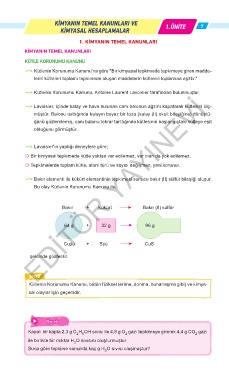
F Bakır elementi ile kükürt elementinin tepkimesi sonucu bakır (II) sülfür bileşiği oluşur.
Bu olay Kütlenin Korunumu Kanunu ile,
Bakır + Kükürt Bakır (II) sülfür
64 g + 32 g 96 g
Cu(k) + S(k) CuS
şeklinde gösterilir.
NOT
Kütlenin Korunumu Kanunu, bütün fiziksel (erime, donma, buharlaşma gibi) ve kimya-
sal olaylar için geçerlidir.
Örnek
Kapalı bir kapta 2,3 g C H OH sıvısı ile 4,8 g O gazı tepkimeye girerek 4,4 g CO gazı
5
2
2
2
ile birlikte bir miktar H O sıvısını oluşturmuştur.
2
Buna göre tepkime sonunda kaç g H O sıvısı oluşmuştur?
2