Page 373 - 8. SINIF VIP TÜM DERSLER KONU ANLATIMLI - EDİTÖR YAYINLARI
P. 373
KİM
KİMYASAL TEPKİMELERYASAL TEPKİMELER 4. ÜNİTE 373
Kimyasal Tepkimeler Nasıl Oluşur? • Tepkimeye giren maddeler ve oluşan ürünler birden
fazla ise aralarına artı ( + ) işareti konulur.
• Günlük yaşamımızda pek çok değişim gözlemleriz.
Bu değişimlerden bazıları maddenin sadece dış gö-
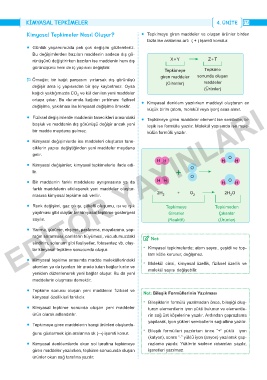
rünüşünü değiştirirken bazıları ise maddenin hem dış X + Y Z + T
görünüşünü hem de iç yapısını değiştirir.
Tepkimeye Tepkime
giren maddeler sonunda oluşan
Ő Örneğin; bir kağıt parçasını yırtarsak dış görünüşü (Girenler) maddeler
değişir ama iç yapısından bir şey kaybetmez. Oysa (Ürünler)
kağıdı yaktığımızda CO ve kül denilen yeni maddeler
2
ortaya çıkar. Bu durumda kağıdın yırtılması fiziksel • Kimyasal denklem yazılırken maddeyi oluşturan en
EDİTÖR YAYINLARI
değişime, yakılması ise kimyasal değişime örnektir.
küçük birim (atom, molekül veya iyon) esas alınır.
• Fiziksel değişimlerde maddenin tanecikleri arasındaki • Tepkimeye giren maddeler element ise sembolle, bi-
boşluk ve maddenin dış görünüşü değişir ancak yeni leşik ise formülle yazılır. Molekül yapısında ise mole-
bir madde meydana gelmez. külün formülü yazılır.
• Kimyasal değişimlerde ise maddeleri oluşturan tane-
ciklerin yapısı değiştiğinden yeni maddeler meydana
gelir. O
• Kimyasal değişimler, kimyasal tepkimelerle ifade edi- H H O H H
lir. + O
• Bir maddenin farklı maddelere ayrışmasına ya da H H H O H
farklı maddelerin etkileşerek yeni maddeler oluştur-
masına kimyasal tepkime adı verilir. 2H 2 + O 2 2H O
2
• Renk değişimi, gaz çıkışı, çökelti oluşumu, ısı ve ışık Tepkimeye Tepkimeden
yayılması gibi olaylar bir kimyasal tepkime göstergesi Girenler Çıkanlar
sayılır. (Reaktif) (Ürünler)
• Yanma, çürüme, ekşime, paslanma, mayalanma, yap-
rağın sararması, canlıların büyümesi, vücudumuzdaki { Not:
sindirim, solunum gibi faaliyetler, fotosentez vb. olay-
lar kimyasal tepkime sonucunda oluşur. • Kimyasal tepkimelerde; atom sayısı, çeşidi ve top-
lam kütle korunur, değişmez.
• Kimyasal tepkime sırasında madde moleküllerindeki
atomları ya da iyonları bir arada tutan bağlar kırılır ve • Molekül cinsi, kimyasal özellik, fiziksel özellik ve
molekül sayısı değişebilir.
yeniden düzenlenerek yeni bağlar oluşur. Bu da yeni
maddelerin oluşması demektir.
• Tepkime sonucu oluşan yeni maddenin fiziksel ve Not: Bileşik Formüllerinin Yazılması
kimyasal özellikleri farklıdır.
• Bileşiklerin formülü yazılmadan önce, bileşiği oluş-
• Kimyasal tepkime sonunda oluşan yeni maddeler turan elementlerin iyon yükü bulunur ve elementle-
ürün olarak adlandırılır. rin sağ üst köşelerine yazılır. Ardından çaprazlama
• Tepkimeye giren maddelerin hangi ürünleri oluşturdu- yapılarak, iyon yükleri sembollerin sağ altına yazılır.
• Bileşik formülleri yazılırken önce “+” yüklü iyon
ğunu göstermek için aralarına ok (→) işareti konur.
(katyon), sonra “-” yüklü iyon (anyon) yazılarak çap-
• Kimyasal denklemlerde okun sol tarafına tepkimeye razlama yapılır. Yüklerin sadece rakamları yazılır,
giren maddeler yazılırken, tepkime sonucunda oluşan işaretleri yazılmaz.
ürünler okun sağ tarafına yazılır.